卵巣がん関連腹膜中皮細胞に
着目した
腹膜播種形成の
病態解明と新規治療戦略
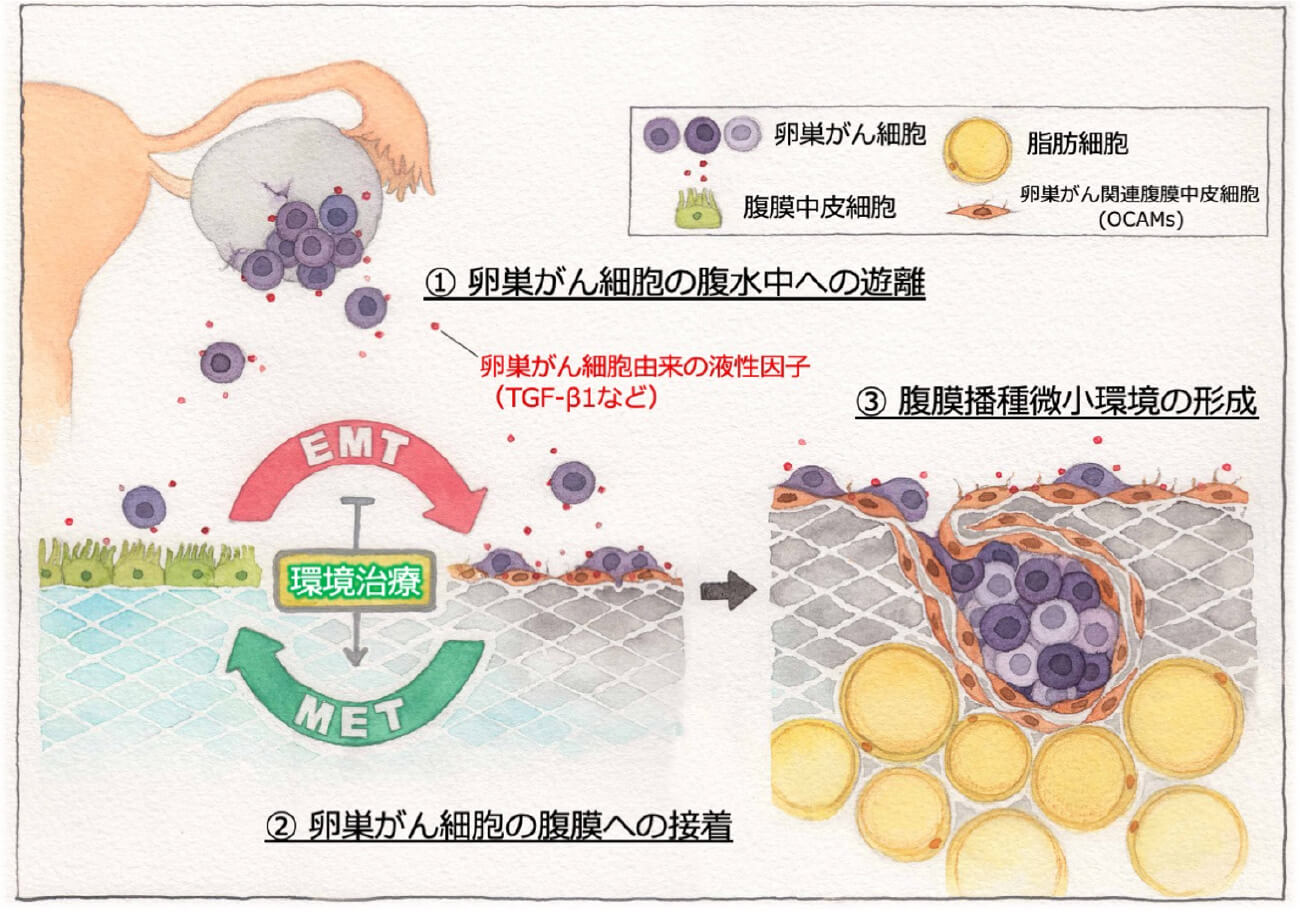
卵巣がん細胞が腹膜播種を起こすホスト細胞としては、腹膜中皮細胞が挙がりますが、もともと腹膜中皮細胞は通常、敷石状形態をとり、臓側あるいは壁側腹膜の表層を覆うことで、腸管などとの摩擦の緩衝、様々な生理活性物質の生成・分泌、そして腹腔内の創傷治癒に関与していることが知られています。ここで1つの疑問が生じますが、卵巣がんが播種する際、腹膜中皮細胞が、“防御的”に機能するのか、それともがん細胞の“initial contact”の足場としてがんの進展を“助ける”ものであるのか?ということです。近年、がん微小環境を構成する様々な細胞が、多様な増殖因子や生理活性物質を産生することで、治療抵抗性の維持やがん細胞の増殖、浸潤転移などを制御していることが判明しています。それら主要な細胞集団の1つに、がん関連線維芽細胞(CAFs)と呼ばれる細胞集団の存在が指摘されています。私たちはこれまでに、卵巣がん側の因子によって、本来防御的な腹膜中皮細胞が変貌を遂げ、α-SMAを高発現する卵巣がん関連腹膜中皮細胞(ovarian cancer-associated mesothelial cells:OCAMs)に変化することを見いだしました。
OCAMsの本質は腹膜中皮細胞の上皮間葉転換であり、実際にOCAMsが基底膜の下、約90μmの範囲に広がる毛細リンパ管や毛細血管網から構成される血液腹膜関門を破壊し、それらの透過性を著しく高め、多量の腹水生成に寄与すること、そして、それらを標的とすることによって腹水量を減少に導き、がん性腹膜炎状態の改善に寄与できることを解明しました(Fujikake K et al, Oncol Rep. 2018)。さらに卵巣がんを助長する腹腔内因子として免疫細胞や脂肪細胞の影響が考えられ、それらが一体となって腹膜環境の生態系を構築し、がん性腹膜炎の形成に大きな役割を担っていることが解明されつつあります。これらのステップで重要な点は、腫瘍細胞の間葉系形質の獲得とがん-腹膜の協調的細胞クロストークの開始と拡大にあります。実際にOCAMsへと変貌した腹膜中皮細胞では、一種のケモカインの分泌が亢進し、その受容体であるケモカインレセプターを高発現する卵巣がん細胞を能動的に腹膜側に誘導し、結果として“Seed & Soil”的に腫瘍が腹膜に引き寄せられ腹膜播種を増加させるメカニズムが判明しました(Peng Y, et al, Cancer Lett 2019, Yasui H, et al, Clin Exp Metastasis. 2020)。
またOCAMsは間葉系形質を獲得した卵巣がん細胞と協調することによって、腹腔内における腫瘍のプラチナ耐性に深く関与することが判明しました(Yoshihara M, et al, Int J Cancer 2020)。こうした腹膜播種の攻略には、腹膜全体をターゲットとしたOCAMsを正常な腹膜中皮細胞へと改変させる戦略が不可欠であると考えます。こうした構想の中で、私たちはこれまでに、OCAMsを正常化させる薬物候補をすでに複数同定しており、「腹膜環境の正常化」によって、がん性腹膜炎を制御する新規治療戦略を目指しております。
がん細胞外小胞エクソソームの
婦人科悪性腫瘍における
機能解析と臨床応用
あらゆる細胞が放出する直径100nm前後の小さな脂質二重膜小胞、エクソソームは、細胞間情報伝達手段の一つとして2007年頃より急速に注目を集めています。エクソソームは多様な細胞外小胞(Extracellular Vesicle: EV)の一つのサブタイプであり、EVは様々な生理活性物質を詰めこんだ複合体という特徴を有し、発がん・転移・悪性化に関わる重要な役割を持っており、ヒト体液中に豊富に含まれ、循環し、病態を反映してプロファイルが変化します。EVを対象とした研究は、世界的に今最も注目を集める研究分野の一つといって間違いなく、取り巻く市場も急激に拡大しています。我々の研究グループは、予後の悪い女性生殖器悪性腫瘍である卵巣がんを主な対象として、エクソソームの重要な役割について、これまで国立がん研究センターと共同で精力的に研究してきました。
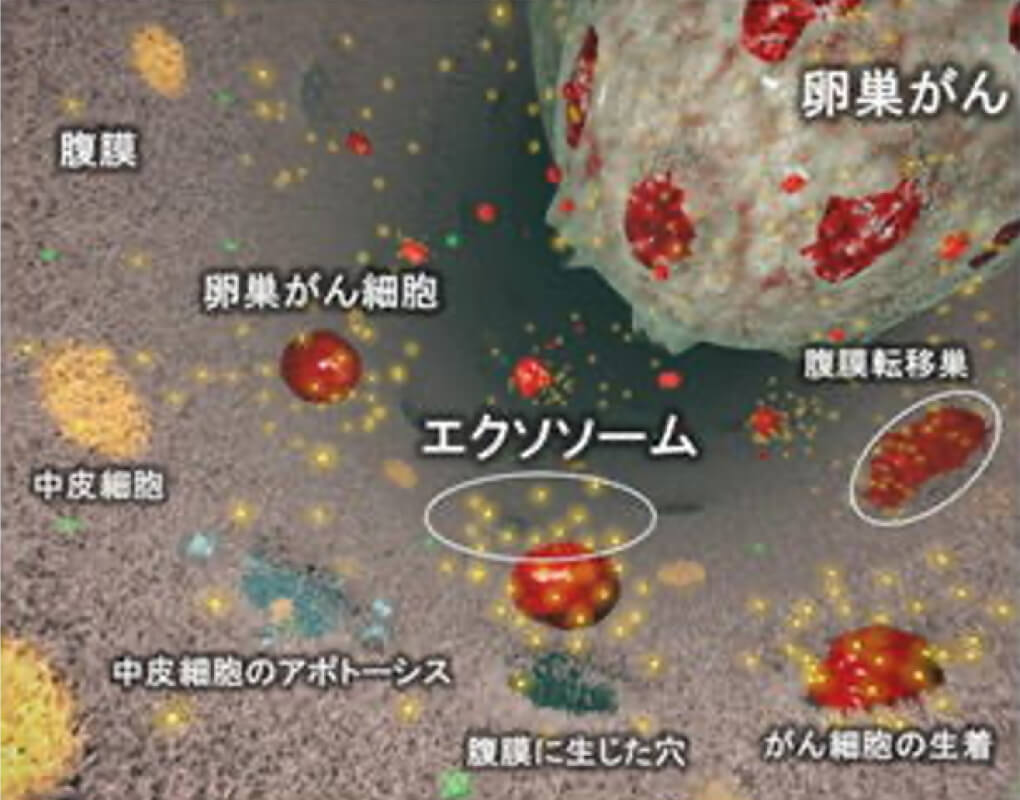
2017年に、卵巣がん細胞が放出するエクソソームがMMP1メッセンジャーRNAを内包し、腹膜中皮細胞を破壊し、腹膜播種性転移を促進するメカニズムを世界に先駆け解明しました(図:Yokoi A, et al., Nature Communications. 2017)。また、NEDO「体液中マイクロRNA測定技術基盤開発事業」の一環として、卵巣がん患者血液中の10種のエクソソームマイクロRNAを解析し、早期診断アルゴリズムを構築しました(Yokoi A, et al., Nature Communications. 2018)。さらに、米国テキサス大学MDアンダーソンがんセンターと共同で、卵巣がん細胞が分泌するエクソソームに含まれるDNAの生合成機構についての解析も行いました(Yokoi A, et al., Science Advances. 2019)。我々は、EVおよびエクソソームに内包される様々核酸の研究を通して、がん悪性化病態解明へのEVの強い関与や、がん臨床バイオマーカーとして、また新しい治療応用としての可能性を確信し、現在も国内有数の医療機関・研究施設と共同研究を遂行しています。また、次世代シーケンサーによるマイクロRNA網羅解析を軸とした、疾患機構解明にも取り組んでおり、産婦人科教室でしか経験できないような疾患を対象とした、ユニークなトランスレーショナル研究も展開しています (Yoshida et. al. Carcinogenesis. 2019, Yoshida et. al. Oncogene. 2021)。さらに、文部科学省研究大学強化促進事業の支援を受け、名古屋大学高等研究院「ナノテクノロジーによるがん細胞外小胞研究ユニット」を設立し 、工学分野との共同研究や、内閣府AMED革新的がん医療実用化研究事業による支援などの下、社会還元へ繋がるような、EVの臨床応用を目指して最先端の研究を行っています。
非平衡大気圧プラズマの
卵巣癌治療応用を
目指した基礎研究
大気圧プラズマを人体に照射して、病気や怪我を治す「プラズマ医療」の研究が近年世界中で盛んに進められている。大気圧プラズマの応用といえば、環境汚染ガス処理、水処理、表面処理、殺菌などが思い浮かぶが、これを止血、創傷治癒、そして癌治療にまで応用する研究である。プラズマ医療では、活性種が癌細胞を攻撃したり、けがをした部分の細胞を適度に刺激して治癒を早める、といった治療原理が考えられている.細胞レベルではすでに著しい効果が多数報告されており、動物実験もいくつか始められている。
この10年間にわたって正常細胞のみならず、脳腫瘍、大腸癌、皮膚がん、肺癌、膵癌および卵巣癌などにおいてプラズマ照射がアポトーシスによる細胞死を誘導することが示されてきた。このプラズマのもたらすアポトーシスの作用は、プラズマから発せられるフリーラジカルを含む活性酸素種(ROS)などによる細胞の酸化還元平衡の障害に起因するDNAの損傷によるものであると考えられている。これまでのいくつかの報告からプラズマの細胞増殖抑制作用は正常細胞に比して腫瘍細胞で強いという一定の細胞選択性があることが示唆されてきている。この選択制は癌細胞の高い増殖活性に基づく細胞内ROSレベルの相違に起因すると考えられている。
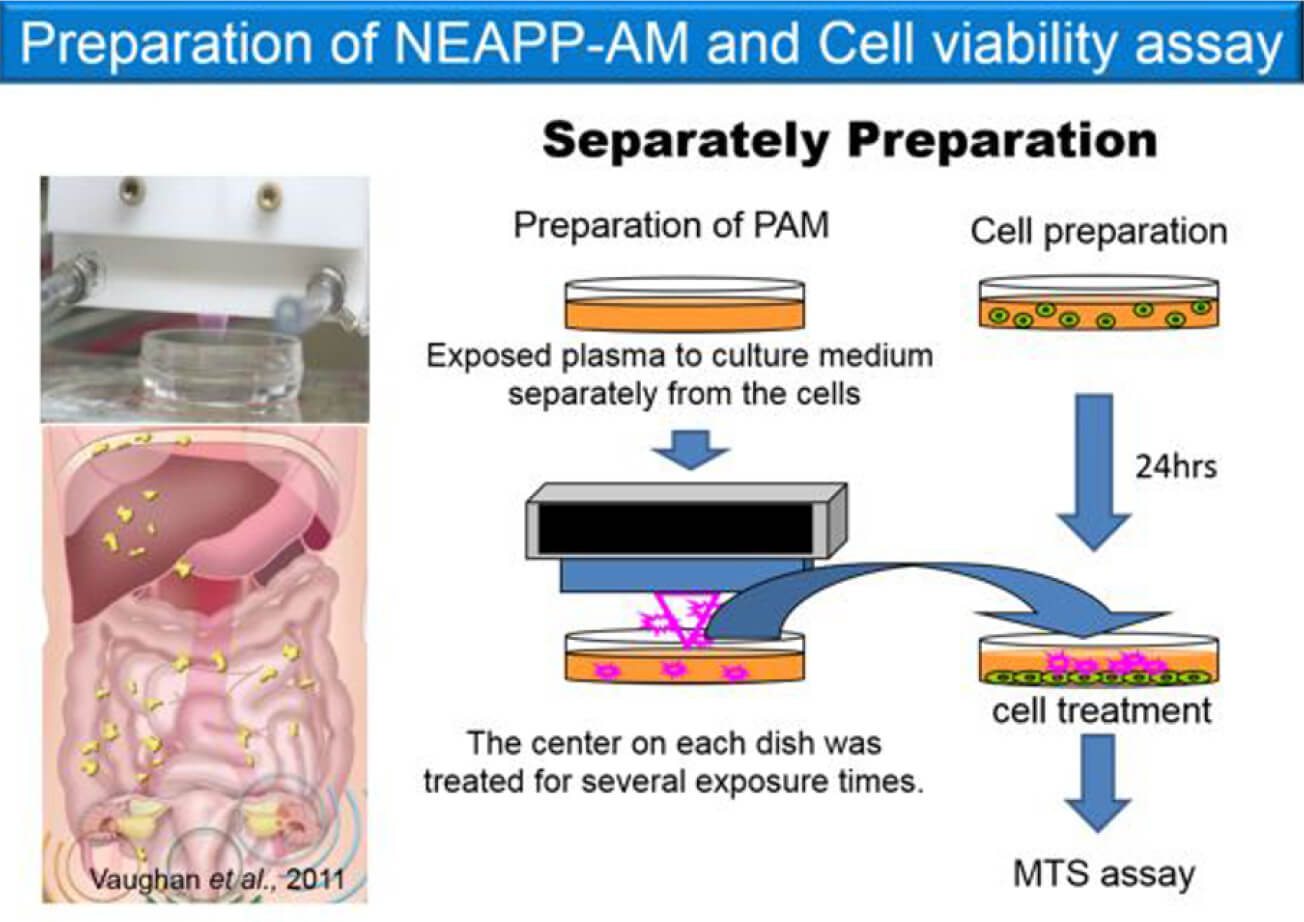
以上の背景をもとに我々は、主に卵巣癌の腹腔内播種という進行形態の効果的な抑制方法として、大気圧プラズマを培養液に照射し(PAM; Plasma activated-medium)その溶液を投与するという腹腔内投与が可能な間接照射を利用したプラズマ癌治療を探求している。また、プラズマの持つ抗腫瘍効果の分子学的な解明やプラズマが卵巣癌の播種に促進的に働く上皮間葉形態転換現象(EMT: Epithelial-Mesenchymal Transition)に与える影響を調査している。
絨毛癌における
糖転移酵素GnT-IVaおよび
C2GnTの発現と機能解析
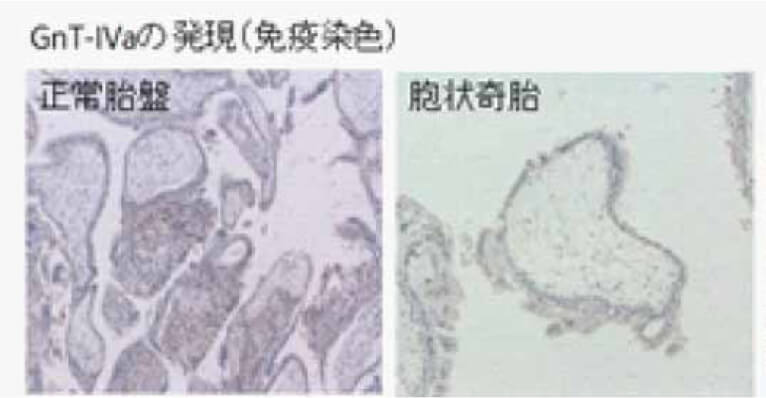
胞状奇胎から侵入奇胎をへて絨毛癌へと癌化することが知られていますが、そのメカニズムは解明されていません。すべての絨毛性疾患および胎盤の栄養膜細胞から分泌されるhCGは、腫瘍マーカーとしても用いられますが、アスパラギン結合糖鎖は4カ所、セリン結合糖鎖は4カ所結合できる部位をもっています。正常妊娠や胞状奇胎に比べると、侵入奇胎、さらに絨毛癌では過剰糖鎖付加hCGが顕著に増加することが明らかになっています。絨毛細胞の悪性化に伴い分泌される過剰糖鎖付加hCGの原因となる糖転移酵素N-acetylglucosaminyltransferase IV (GnT-IV) (1)やCore-2 N-acetylglucosaminyltransferase (C2GnT)-1に注目した研究を行っています。
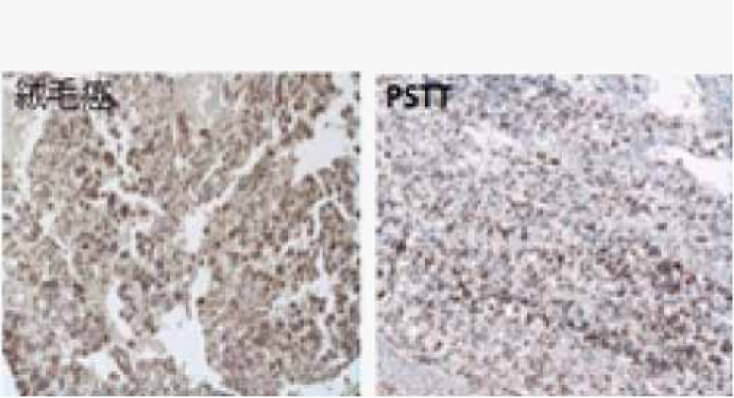
絨毛性腫瘍の責任妊娠の解明
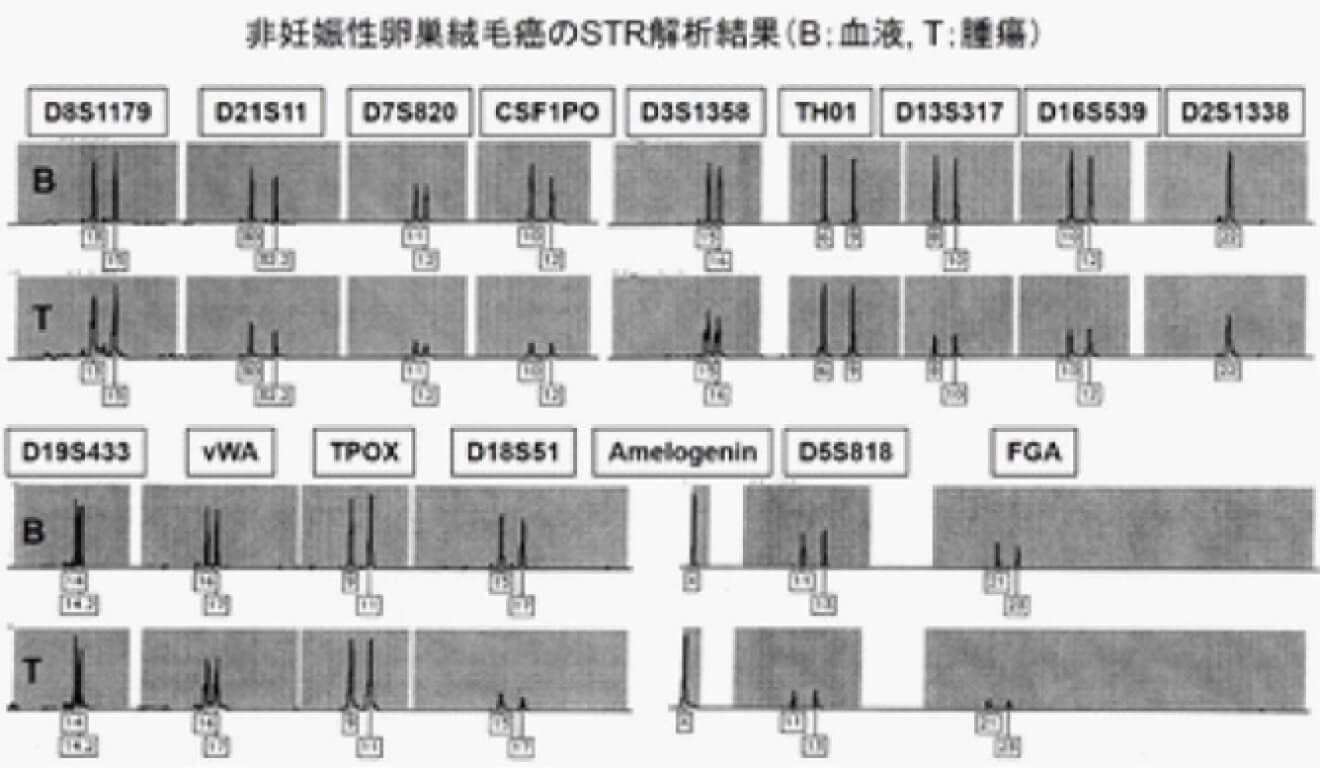
絨毛性腫瘍には、侵入奇胎、絨毛癌、胎盤部トロホブラスト腫瘍(PSTT)、および上皮性トロホブラスト腫瘍(ETT)があります。侵入奇胎は胞状奇胎を由来として発症しますが、その他の絨毛性腫瘍の場合には腫瘍の由来となる責任妊娠は先行妊娠(直前の妊娠)とは限りません。DNA解析を用いて絨毛性腫瘍の責任妊娠を調べています(2)。非妊娠性絨毛癌もDNA解析により診断することができます。
Reference
- High expression of N-acetylglucosaminyltransferase IVa promotes invasion of choriocarcinoma. Niimi K., Yamamoto E., Fujiwara S., Shinjo K., Kotani T., Umezu T., Kajiyama H., Shibata K., Ino K., Kikkawa F. Br J Cancer 2012; 107: 1969-1977.
- Identification of causative pregnancy of gestational trophoblastic neoplasia diagnosed during pregnancy by short tandem repeat analysis. Yamamoto E., Niimi K., Shinjo K., Yamamoto T., Fukunaga M., Kikkawa F. Gynecol Oncol Case Rep 2014; 9: 3-6.

